ミオシン11高速化による植物の大型化

シロイヌナズナのミオシン11のモータードメインをシャジクモのものに遺伝子工学的に置換し高速化したところ,シロイヌナズナ細胞内の原形質流動速度が高速化し,シロイヌナズナの植物体が巨大化することを明らかにしました(早稲田大学 富永博士との共同研究)。原形質流動の役割については原形質流動の発見から200年にわたり明確な答えがありませんでしたが,本研究により,原形質流動は植物の大きさを規定する要因の一つということが明らかにしました。植物細胞におけるかったが本研究はそれに対しての回答を与えました。現在はこのシステムを用いて資源植物である単子葉植物の大型化,穀物量の増大を目指して研究を行っています。
シャジクモのミオシン11の高速運動の分子基盤の解明
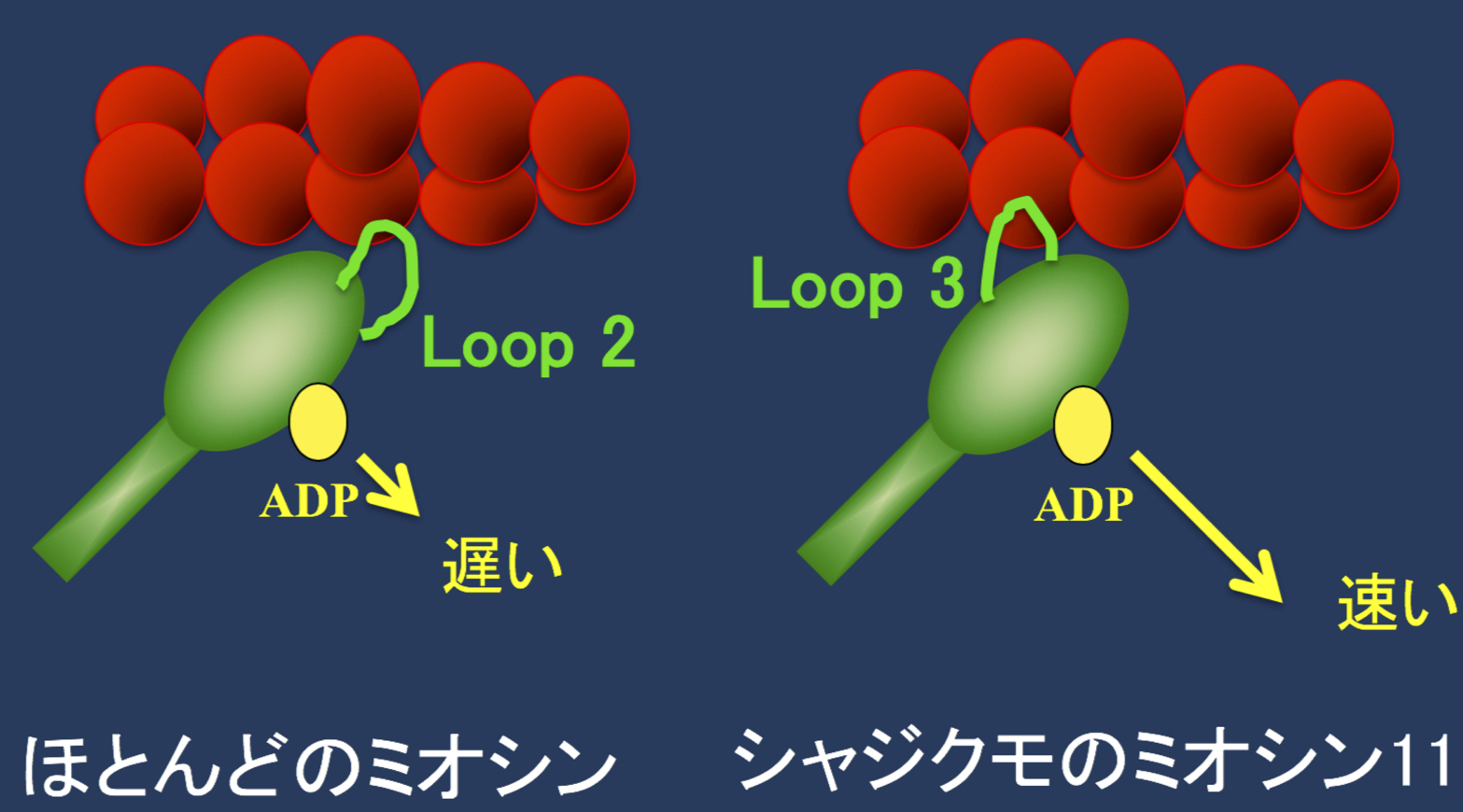
シャジクモのミオシン11は他のすべての動植物のミオシンと比べて桁違いに速い生物界最速のミオシンです。何故,それほど速度が速いのかをストップドフロー装置を用いたキネティクス解析を行った結果,アクトミオシンからのADP解離速度が非常に速く,それにより超高速運動を行っていることがわかりました。さらに,ほとんどのミオシンはループ2と呼ばれる領域でアクチンと結合しますが,シャジクモのミオシン11はループ3で結合し,アクトミオシンからのADP解離速度を加速させていることがわかリました。現在はシャジクモのミオシン11の結晶化によりさらなる高速運動をおこす分子基盤の解明を目指しています。
シロイヌナズナの13種類のミオシン11の機能解析
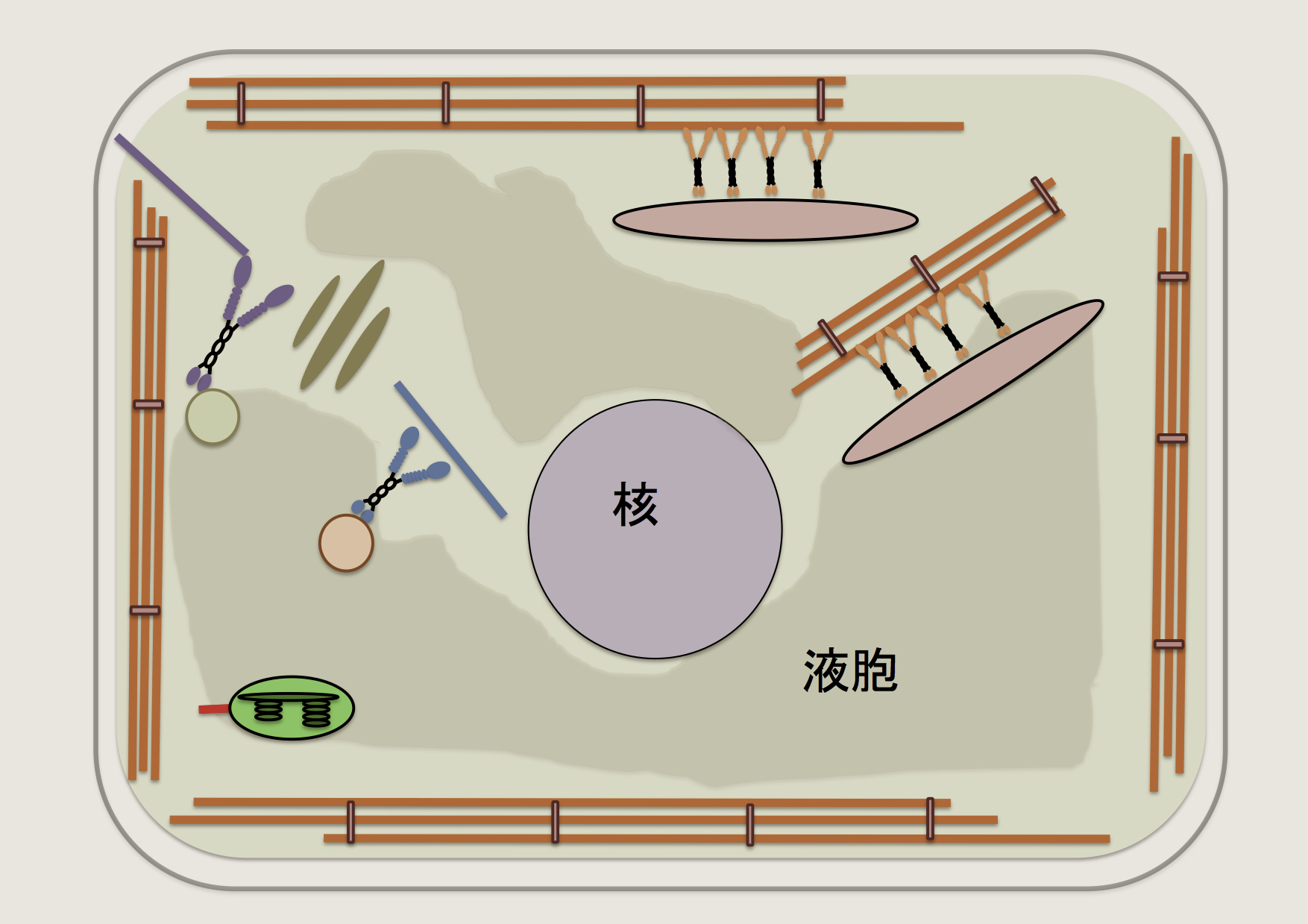
シロイヌナズナには13種類のミオシン11が発現しています。一般に同じクラスのミオシンは速度や酵素活性などの特性は同じですが, 13種類のミオシン11は速度も酵素活性も大きく異なり,高速,中速,低速の3つのタイプに分かれることがわかました。さらに高速は生殖成長時期に多く発現し,中速は普遍的に発現し,低速も普遍的だが,発現場所が核の周囲特異的であることがわかりました。これにより,高等植物は成長や役割に応じて速度,酵素活性が異なるミオシン11を使い分けていることがわかりました。現在は13種のミオシン11とシロイヌナズナに発現している8種類のアクチンとを「どのように選んでいるか」を調べています。
ミオシン11によるアクチンの自律的な極性配向機構
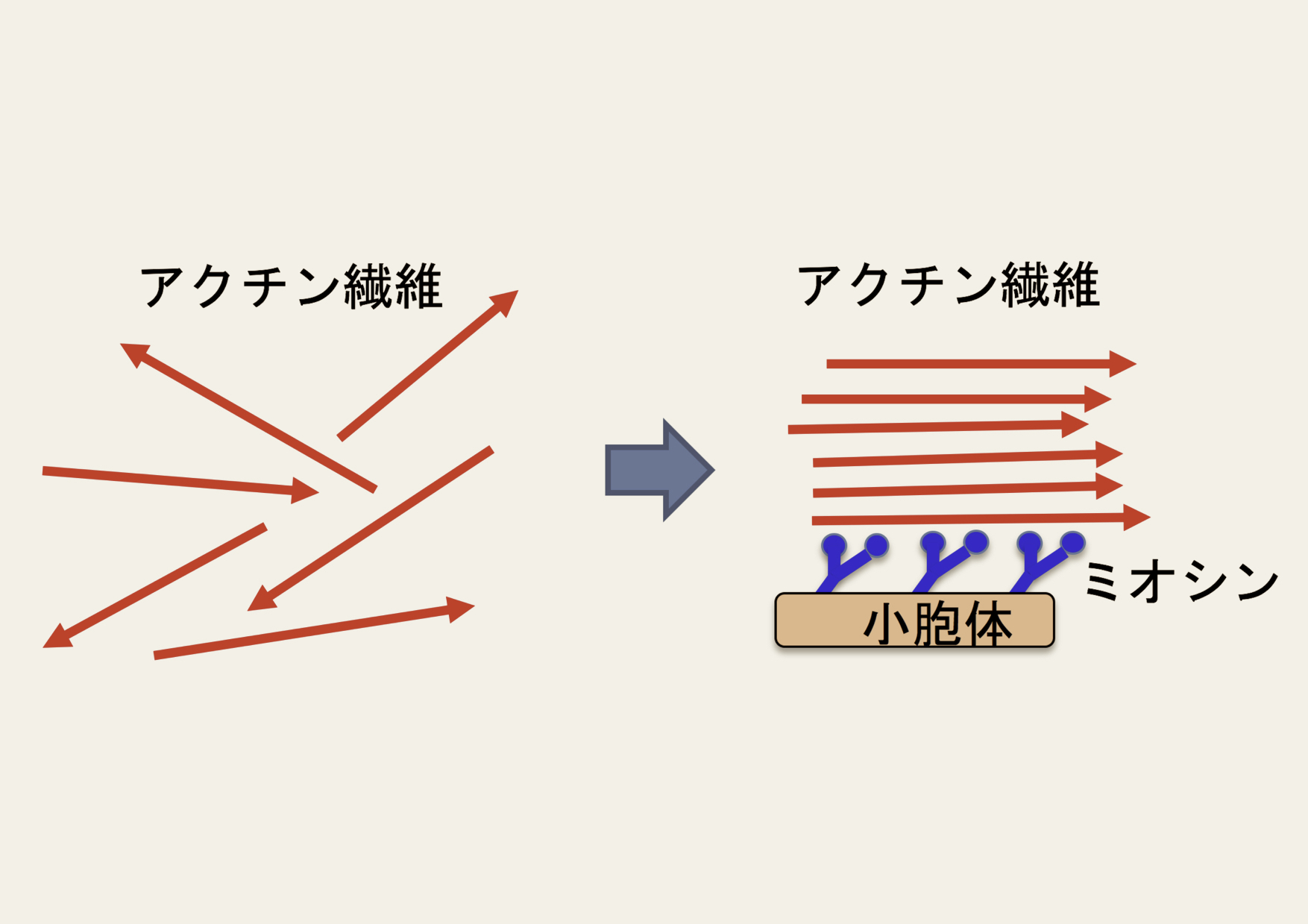
植物細胞は細胞膜近傍のわずかな細胞質領域にアクチン繊維の束が一方向性の極性をもって並んでいます。このため,小胞体に結合したミオシン11が一方向性に並んだアクチン繊維の上を,アクチンの極性にそって一方向に動くので,植物細胞には原形質流動と呼ばれている「一方向性の細胞内の流れ」が起こっています。原形質流動が効率良く生じるためには,アクチン繊維が一方向性の極性をもって配向することが非常に重要です。では,どのような機構によってアクチン繊維が一方向性の極性を持って並ぶのでしょうか?私達は,in vitroの実験系を使ってこの問題に取り組んでいます。
生物界で最速のミオシンの探索とその構造解析
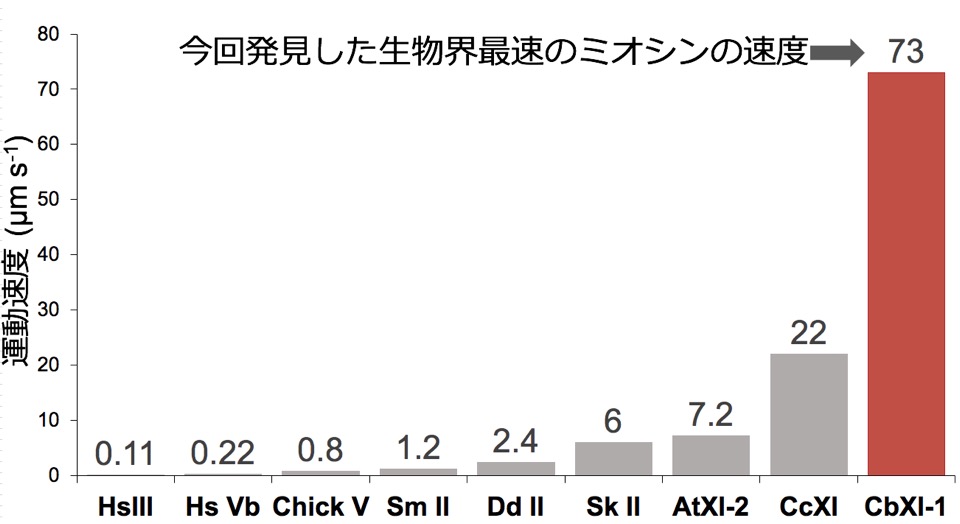
シャジクモの原形質流動速度は桁違いに速いので,シャジクモ内には「生物界最速のミオシン」が存在することが示唆されていました。そこでシャジクモ (Chara braunii)から4つのミオシン11をクローニングし,運動速度解析をしました。その結果,Cb11-1がシャジクモの原形質流動と同程度の速度をもつ,生物界最速のミオシンであることを明らかにしました。さらに,世界で初めてミオシン11の結晶構造から高分解能の立体構造を決定し,超高速の運動にアクチン結合部位が関わることを明らかにし,変異体実験からも実証しました。現在は変異体を用いてより詳細にミオシン11の超高速の運動に関わる部位を調べています。
ミオシン11の自己制御機構の解明
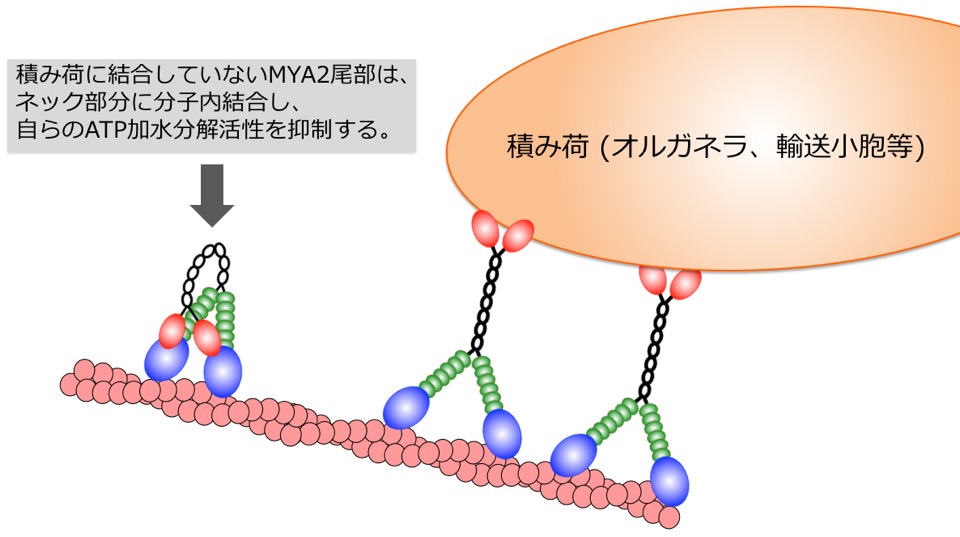
原形質流動は植物の生存に関わるため,その制御機構の解明は重要です。シロイヌナズナのミオシン11のMYA2は小胞体などのオルガネラに結合し,原形質流動を駆動する役割を担っています。しかし,MYA2の活性制御機構は不明でした。そこで私達は昆虫細胞発現系を用いてMYA2を精製し,運動速度およびATPase活性を測定しました。その結果,MYA2の活性は自己の球状尾部ドメインにより制御されることが明らかになりました。現在は球状尾部ドメインの変異体を作製してより詳細に活性制御機構を解明しています。









