低分子量G蛋白質の細胞機能と生体機能およびその分子機構


| 高野和儀 | 助教 | 分子細胞生物学、筋肥大・筋再生・シグナル伝達 | 自然科学系総合研究棟1 807室 | ktakano#faculty.chiba-u.jp(#→@) |
当研究室では次のことがらについて,シグナル伝達の見地から研究しています.

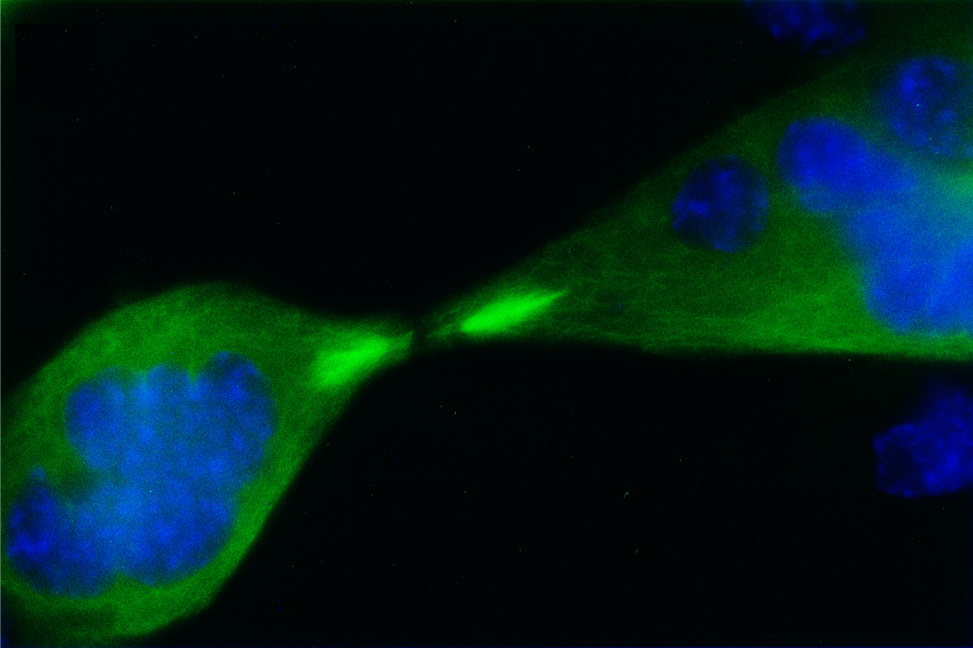
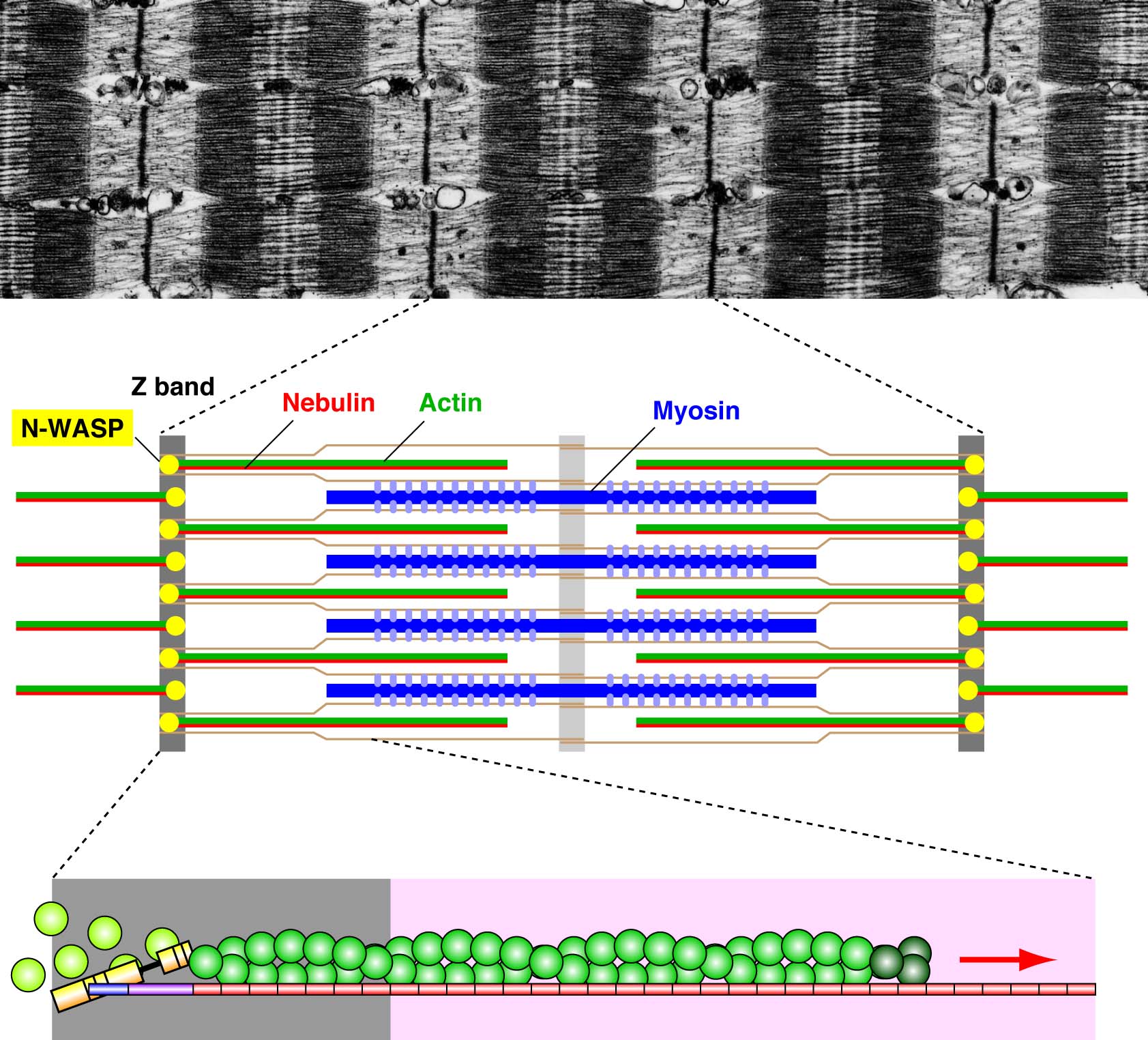
骨格筋は収縮と弛緩を繰り返すことにより,呼吸や生体の運動など生命活動・生命の維持に不可欠な役割を果たしています。骨格筋の成熟過程は筋再生や筋疾患発症のメカニズムを解明する上で重要な現象です。私たちはアクチン制御因子である N-WASP が筋肥大の過程において筋原線維のアクチン線維形成にかかわることを明らかにしました (Science, 2010)。さらに筋再生過程において膜変形タンパク質である Amphiphysin-2/BIN1 や Dynamin2 と協調したアクチン動態制御が骨格筋の成熟を制御するものと考えて,遺伝子改変動物などを用いた研究に取り組んでいます。
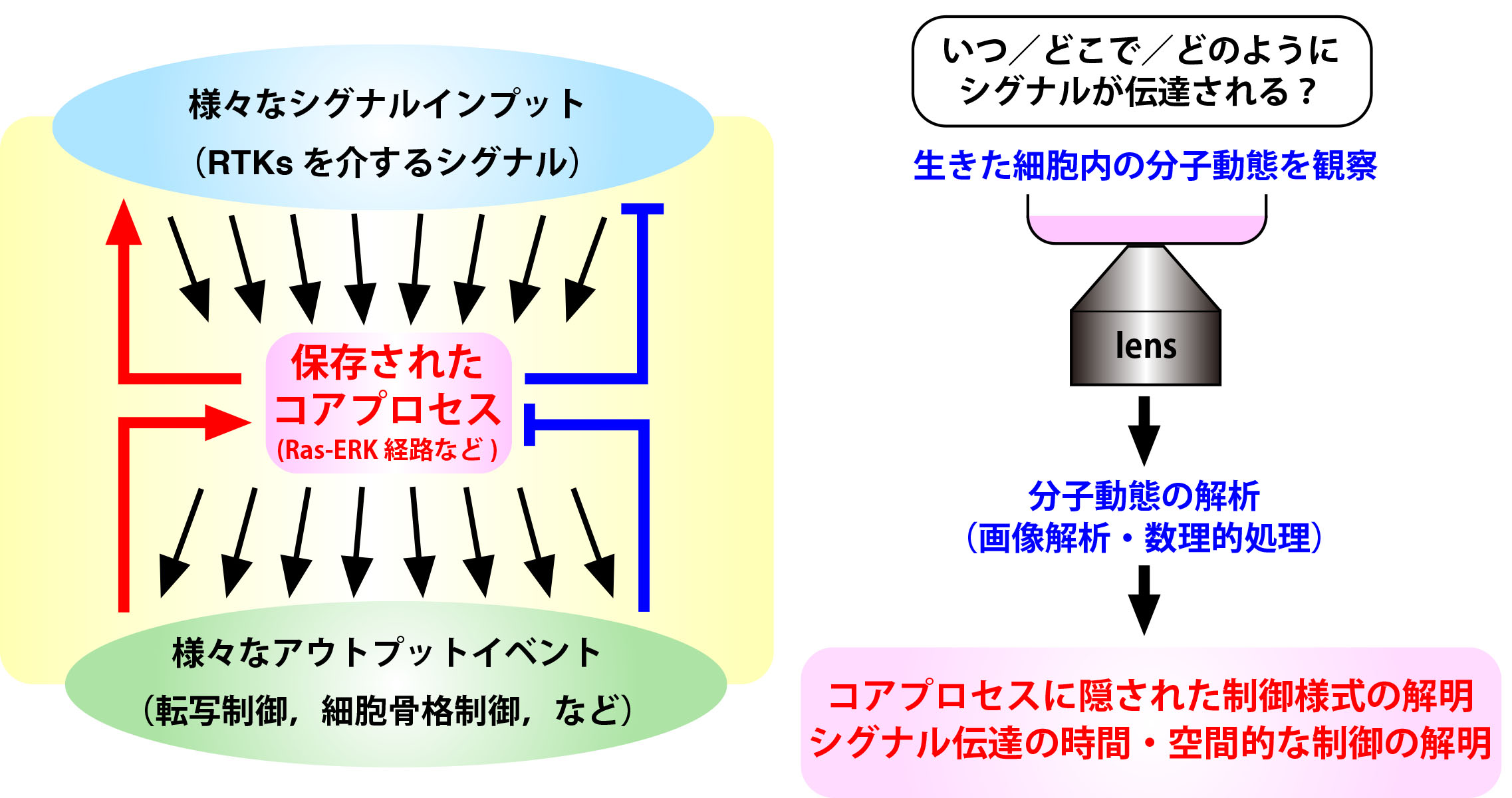
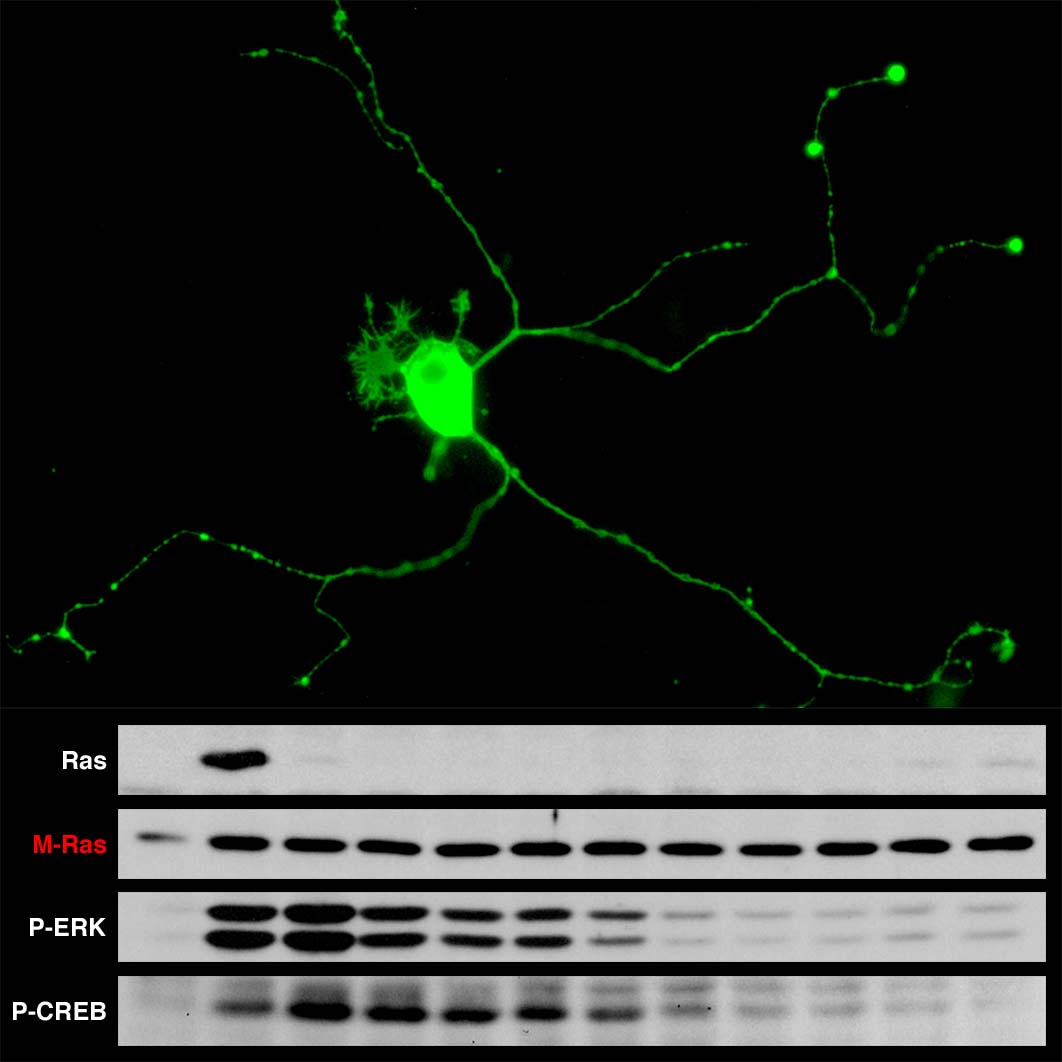
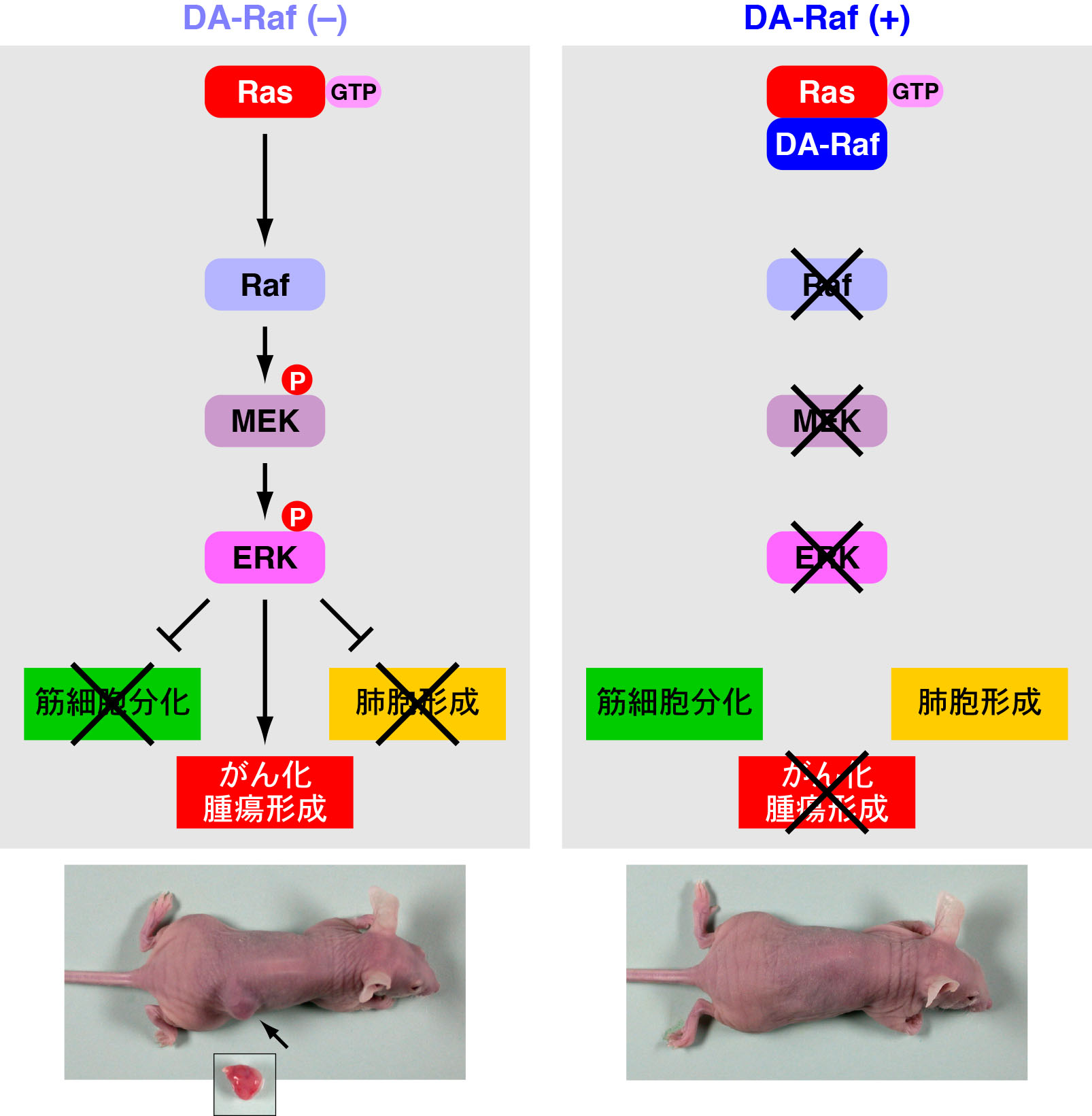
すべての生物にはみずからの活動を絶えず環境変化に順応させる能力があります。これを可能にする『細胞内シグナル伝達』は外界の情報を受容体が受け取り細胞内に伝達する一連の生化学反応とその制御であると定義付けられます。すなわち,細胞内シグナル伝達の制御が破綻することにより疾患が誘導されると考えられます。私たちは細胞増殖や細胞分化,がん化にかかわるRas-ERK経路に着目し,この経路を構成するシグナル分子に蛍光タンパク質を付加させて生きた細胞へ発現させ,生理的条件下で連続的な分子動態を観察・計測 (live-cell imaging) することにより,新たなシグナル伝達の制御様式の解明を目指しています。