統合的なヒストンメチル化酵素の機能解析
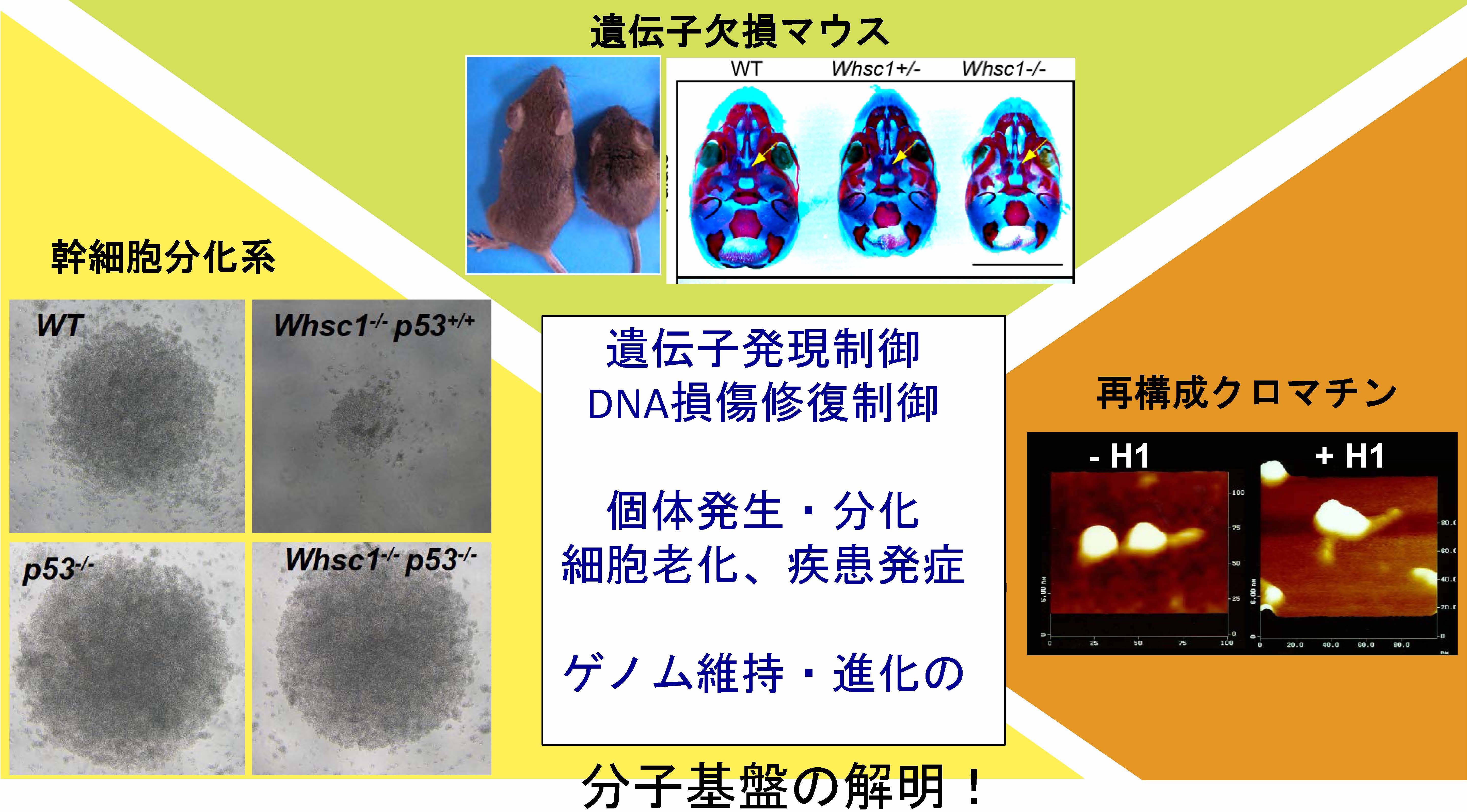
私たちはこれまでにヒストンH3、36番目リジン残基(H3K36)のメチル化酵素の一つ、NSD2がヒト4p症候群の原因因子である事をノックアウトマウスを作成して明らかにしました。ヒストH3K36メチル化は、酵母からヒトまで種を超えて進行中の転写領域をマークするように分布しますが、転写制御との直接の関与は見い出されず、未知のDNA 代謝制御に繋がることが期待されます。現在、NSD2を中心に、主に哺乳類のヒストンH3K36メチル化酵素について、再構成クロマチンから細胞・マウス個体レベルで、転写とDNA損傷修復の両面から統合的な機能解析を行なって、新たなゲノム制御機構の解明を目指しています。
リボヌクレオチドが引き起こす深刻なゲノム不安定化
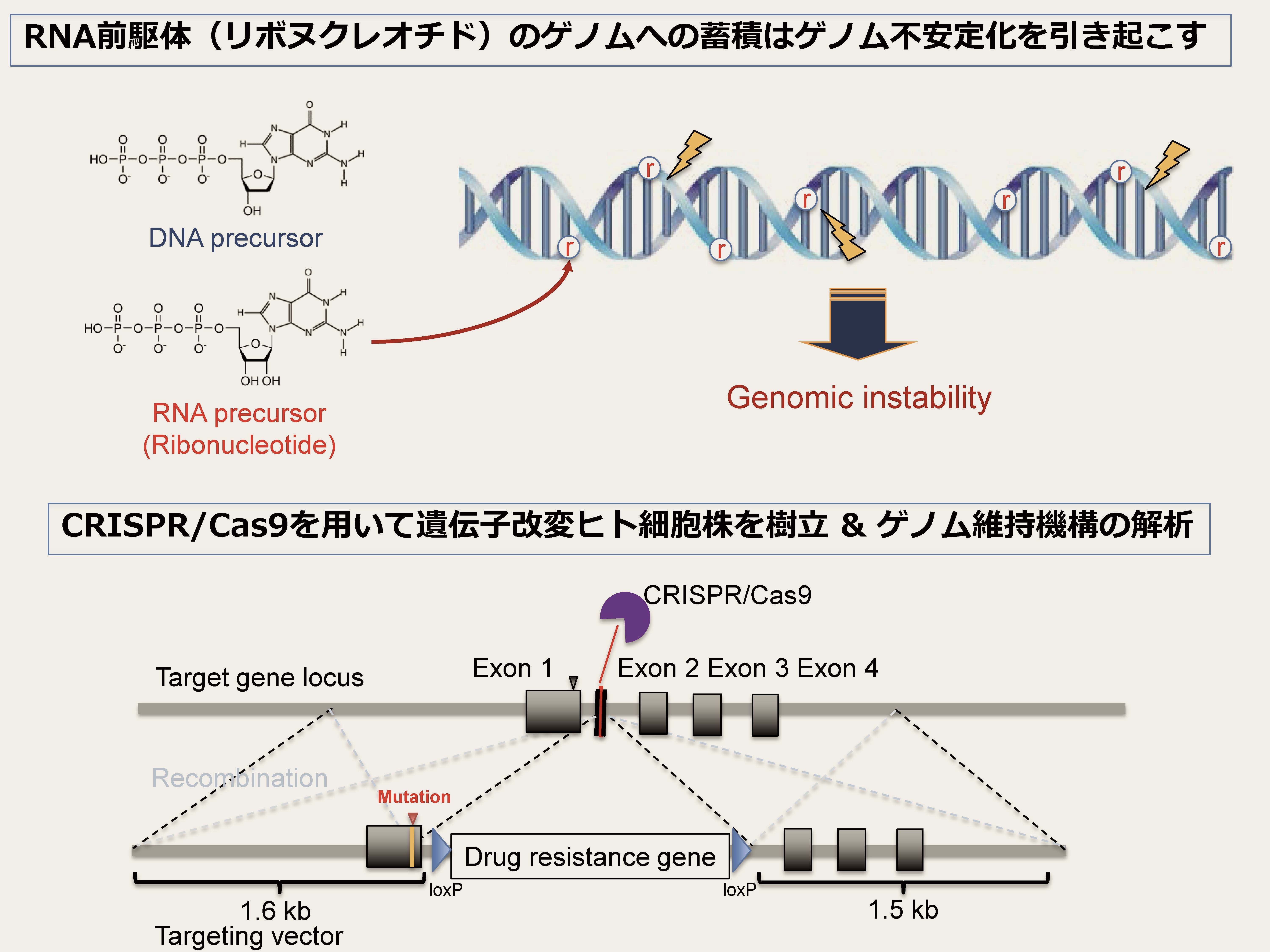
細胞内に豊富に存在するRNA前駆体「リボヌクレオチド」は、しばしばDNAの複製中にゲノムに取り込まれることがあります。その頻度は、細胞あたり実に百万分子にもなり、適切に除去されなければ重篤な神経変性疾患や発がんの引き金になります。当研究室では、ヒト細胞のDNAに取り込まれたリボヌクレオチドが、極めて深刻なゲノム不安定化を引き起こすことを突き止めました。現在、ゲノム編集技術CRISPR/Cas9を利用して樹立した様々な遺伝子改変細胞株を用いて、ゲノム不安定化の分子機構の解明を進めています。
遺伝毒性試験を応用したエピゲノム制御機構の解析
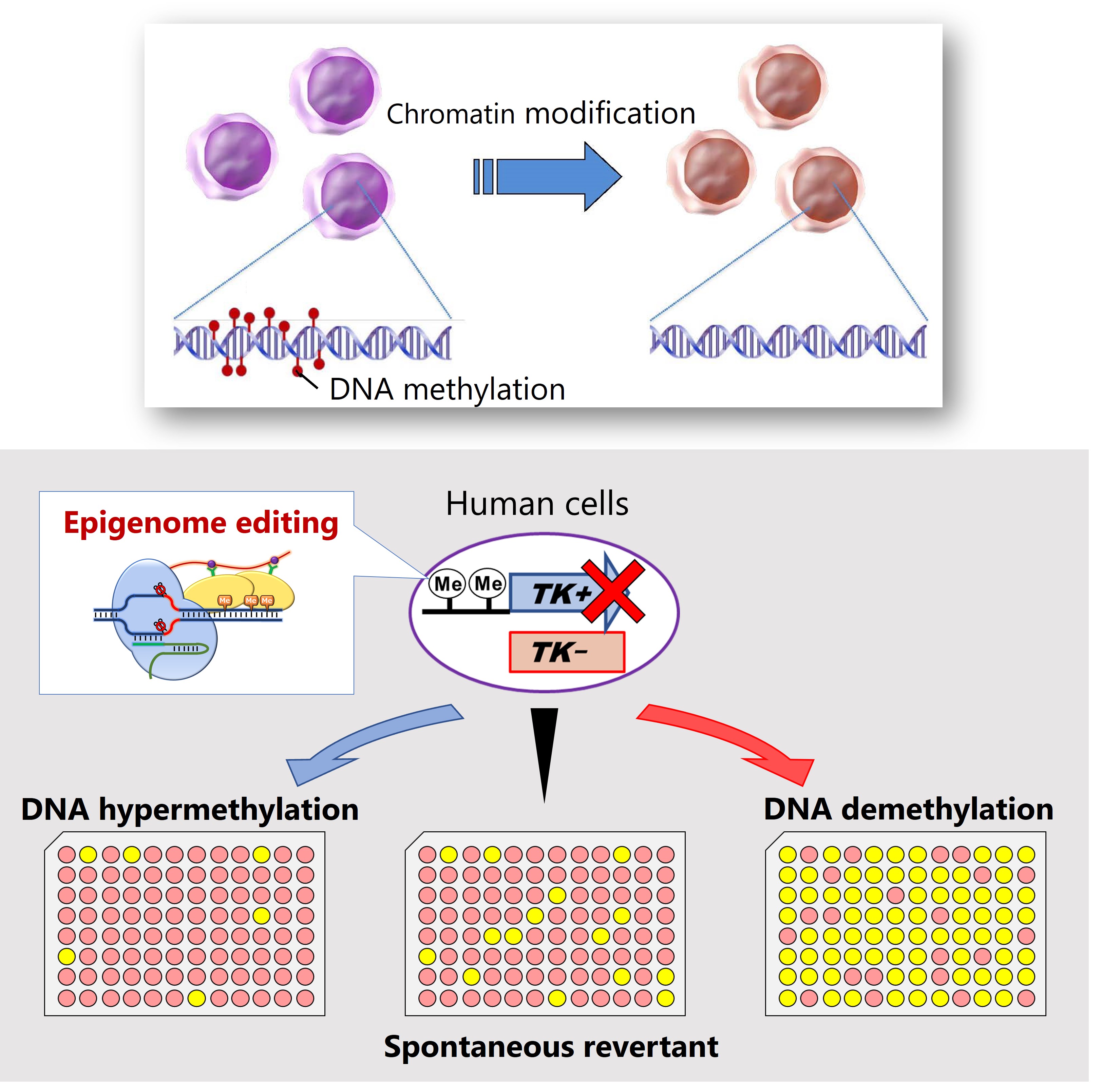
エピジェネティックな遺伝子発現制御は、DNAメチル化やヒストン修飾を介して行われています。細胞のエピゲノム情報は、時に化学物質や酸化ストレスなどの環境要因によっても変化しますが、そのメカニズムについては不明な点が多く残されています。本研究では、哺乳類細胞を用いた化学物質の安全性試験(遺伝毒性試験)を応用して、細胞内のエピゲノム変化を簡便かつ明確に検出する新たなシステム(実験系)の確立、及びそれを用いたエピゲノム制御機構の解析を行っています。
高次ゲノム解析から迫る自然免疫応答の仕組み
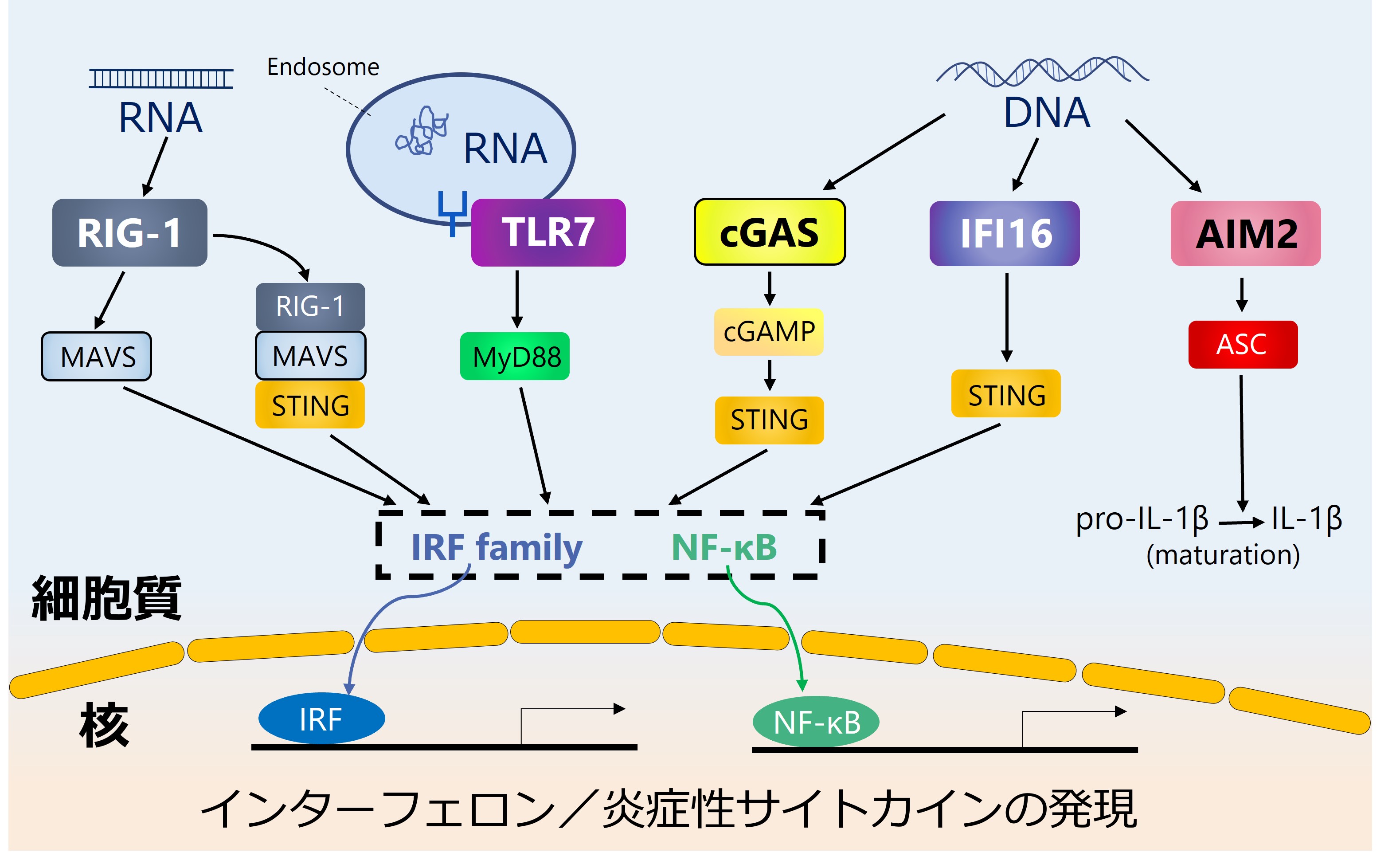
細菌やウイルス感染によって外来核酸が細胞に侵入すると、生体防御反応として自然免疫シグナルが惹起されます。当研究室では、細胞自身のゲノムに傷が蓄積すると、免疫経路が異常に活性化されることを突き止めました。ゲノム異常から疾患に至るメカニズムとして「自然免疫」に焦点を当て、遺伝子突然変異、エピジェネティックな修飾変化、そして染色体立体構造までの次元横断的なゲノム解析によって全貌を解明します。
損傷耐性DNA/RNAポリメラーゼの機能解析
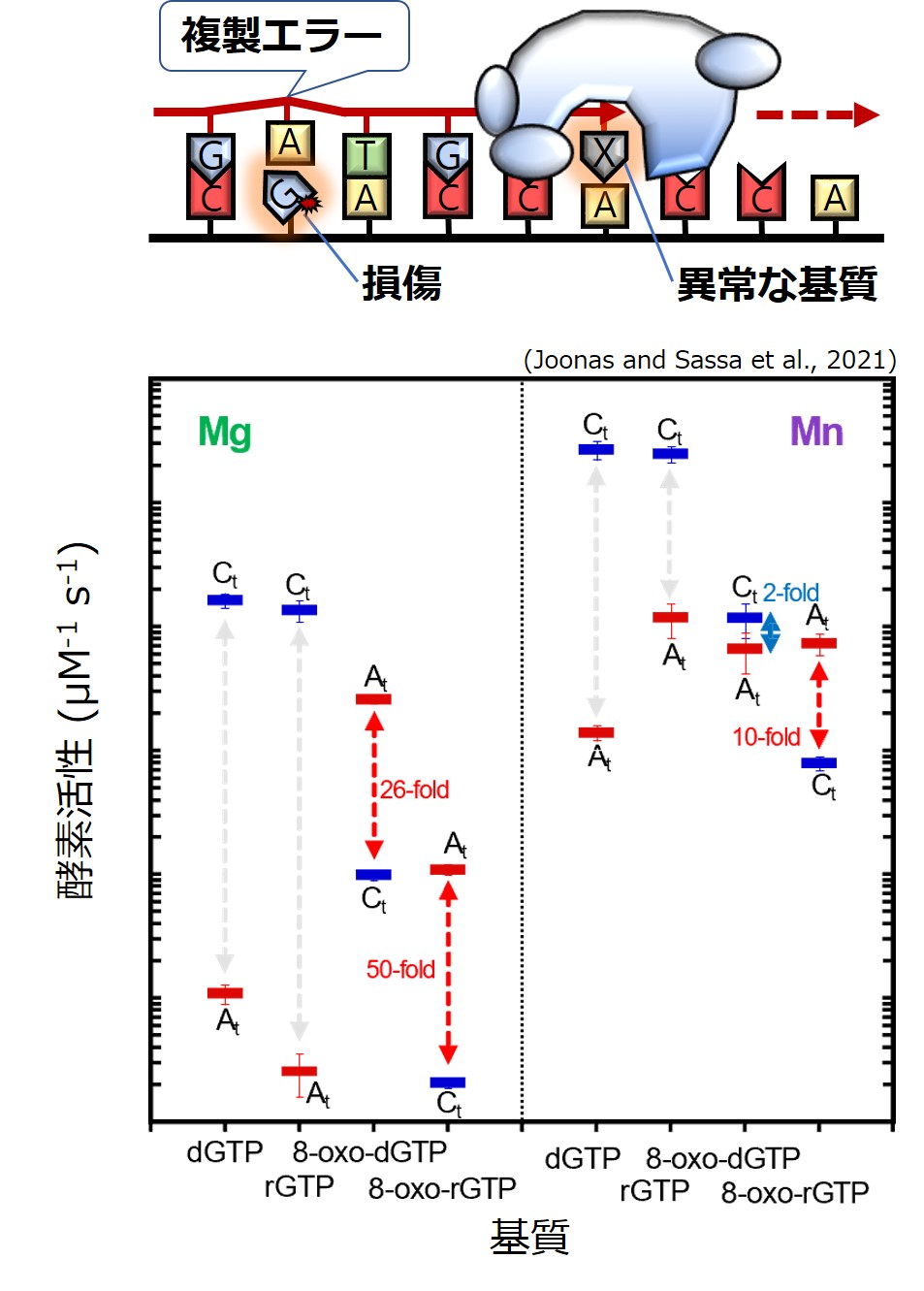
DNAやRNAの複製を担うDNA/RNAポリメラーゼの中には、鋳型に損傷があってもそれを乗り越えて新鎖合成を行う(損傷耐性を持つ)ものや、異常な基質を好んで取り込むものがあります。それらは個体の生存に必要である一方、誤りがちな複製によって遺伝子の変異を促す諸刃の性質を持ちます。私たちは、ヒト、原核生物、ウイルスが持つDNA/RNAポリメラーゼの生化学的解析を通して、誤りがちなゲノム複製の分子機構とその意義を明らかにします。








